De COGEM in cijfers
De in 2021 ingezette daling van uitgebrachte COGEM adviezen, is in 2023 weer omgeslagen in een stijging. In totaal bracht de COGEM 77 adviezen en signaleringen uit, waaronder de Trendanalyse biotechnologie 2023. Daarmee zit de COGEM op het niveau van 2017 en 2019. Verder organiseerde de COGEM in 2023 twee drukbezochte symposia. Al met al was 2023 een bijzonder druk jaar, waardoor de werkdruk sterk opliep mede door een aantal vacatures in het secretariaat.
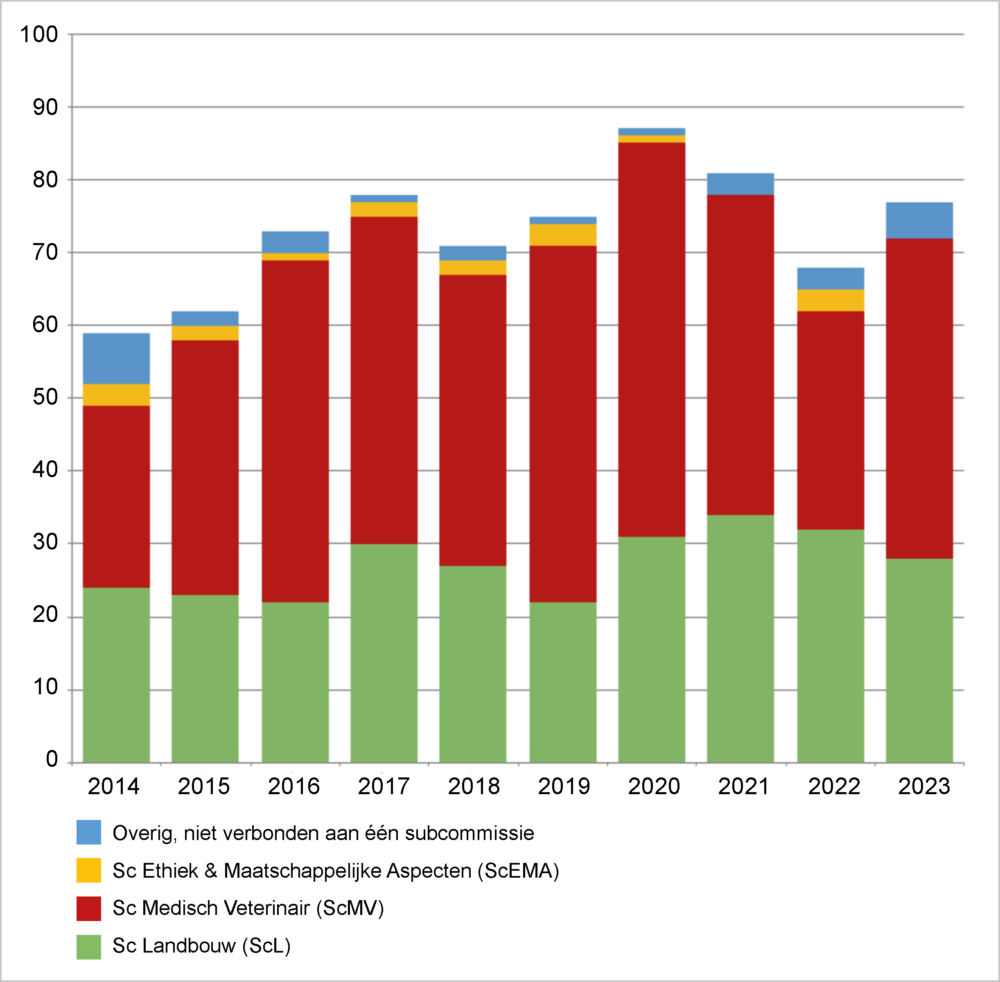
De subcommissie Medisch Veterinair van de COGEM bereidde de meeste adviezen voor (44), terwijl de subcommissie Landbouw 28 adviezen voor haar rekening nam (zie figuur 1). Vijf publicaties werden gezamenlijk door meerdere subcommissies voorbereid.
Het overgrote deel van de adviezen van de COGEM betrof door de vergunningverlener gevraagde adviezen naar aanleiding van vergunningaanvragen (zie figuur 2). Dit kan gaan om vergunningen voor experimenten in laboratoria, dierverblijven of kassen e.d. (Ingeperkt gebruik), klinische en veterinaire studies met ggo’s (Introductie in het Milieu), of commerciële toepassingen (Markttoelatingen). De laatste categorie betreft geen nationale vergunningprocedures maar gecentraliseerde EU-procedures, waarbij een vergunning afgegeven wordt voor alle EU-lidstaten. Een afgegeven vergunning voor markttoelating geldt dan ook voor alle EU-lidstaten. Elke lidstaat wordt in de gelegenheid gesteld om de dossiers te beoordelen en commentaar in te leveren, alvorens er gestemd wordt over de vergunningaanvraag. De COGEM wordt om advies gevraagd over markttoelatingen. De toelatingsprocedure voor import of teelt van genetisch gemodificeerde (gg-) gewassen verloopt via de European Food Safety Authority (EFSA) en die voor medicijnen via de European Medicines Agency (EMA). De laatste procedure is in zijn geheel vertrouwelijk. COGEM adviezen hierover worden dan ook niet gepubliceerd.
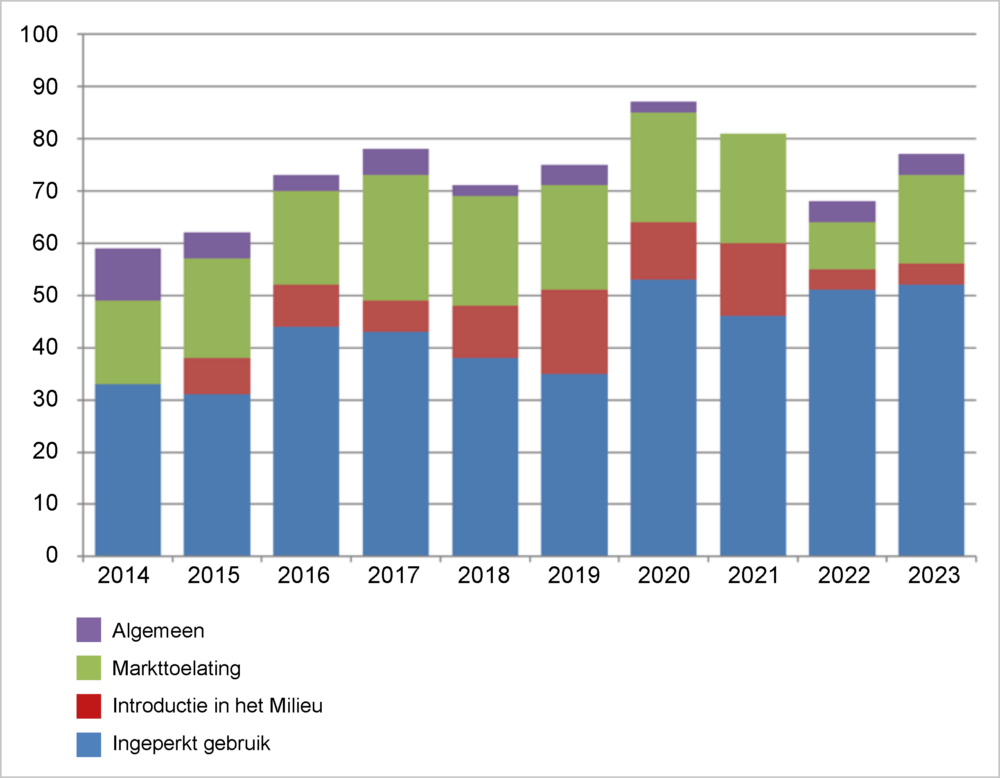
In 2023 heeft de COGEM een groter aantal adviezen over import en verwerking (Markttoelatingen) van gg-gewassen uitgebracht. Het aantal adviezen over Ingeperkt Gebruik vergunningaanvragen bleef ongeveer gelijk, omdat een daling van adviesvragen over werkzaamheden met gg-planten in kassen gecompenseerd werd door een stijging van adviezen op het gebied van medisch en veterinair onderzoek in laboratoria (zie figuur 3)
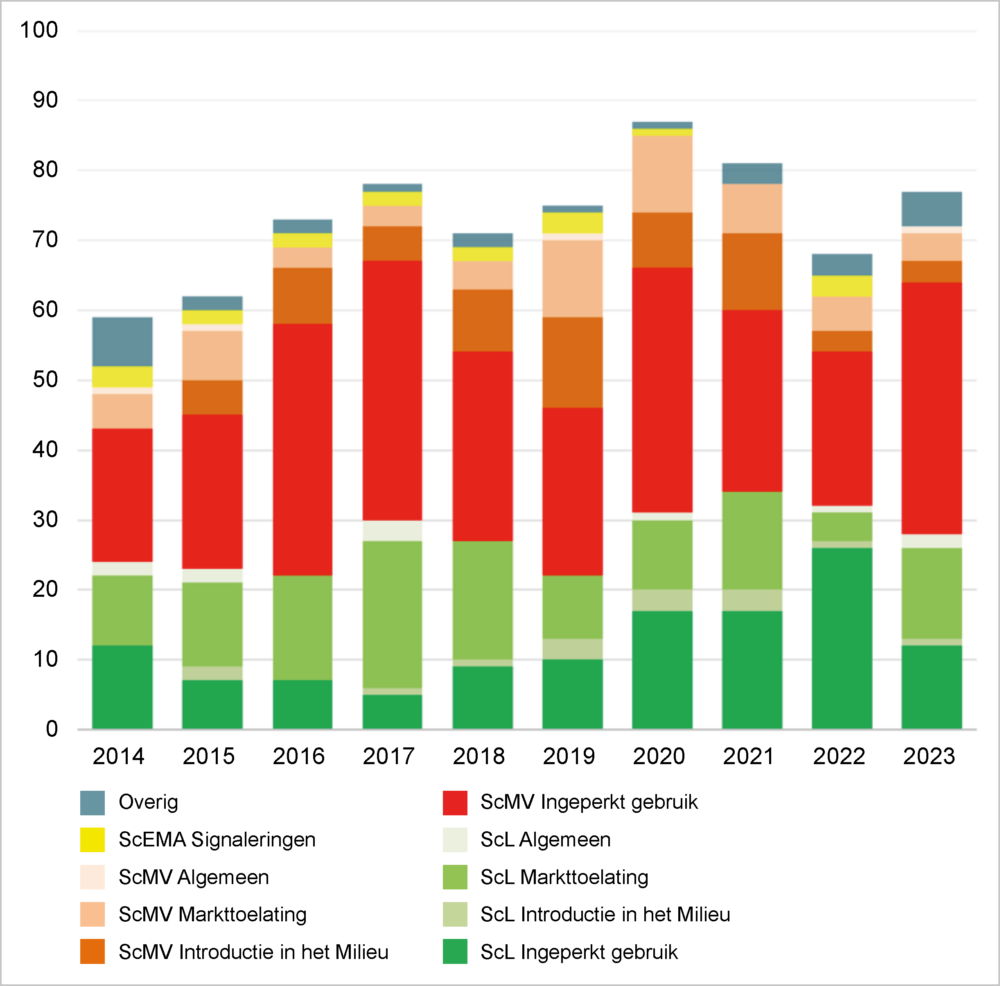
Naast adviezen over specifieke vergunningaanvragen heeft de COGEM ook adviezen van meer generieke aard uitgebracht, waaronder twee adviezen naar aanleiding van het voorstel van de Europese Commissie (EC) voor nieuwe regelgeving voor planten geproduceerd met behulp bepaalde nieuwe genoomtechnieken (NGT’s), i.e. gerichte mutagenese, cisgenese en intragenese, zodat ze niet langer onder de ggo-regelgeving vallen. De COGEM concludeerde in het eerste advies dat het EC-voorstel in lijn is met eerdere adviezen en signaleringen van de COGEM over de noodzaak van aanpassing van de ggo-regelgeving. Wel merkte de COGEM op dat de criteria in het voorstel (Annex 1) over hoe het onderscheid gemaakt moet worden tussen planten die gelijk zijn aan conventionele veredelingsproducten (NGT1-planten) en planten die niet verkregen zouden kunnen worden door conventionele veredeling (NGT2-planten), wetenschappelijke onderbouwing misten. Goed onderbouwde criteria zijn belangrijk omdat NGT1-planten geen veiligheidsbeoordeling hoeven te ondergaan en NGT2-planten wel. Nadat de EC een Technical paper publiceerde waarin een rationale werd gepresenteerd voor haar criteria in Annex I, heeft de COGEM eind 2023 in een tweede advies concrete (tekst)voorstellen gedaan voor verdere aanpassing en verbetering van de Annex I. Ook in de komende tijd zal de COGEM de ontwikkelingen rond de aanpassing van de ggo-regelgeving scherp blijven volgen.
